Wir sind am 01.04. umgezogen! Unsere neue Adresse ist: Reimerstwiete 11, 20457 Hamburg
Wie moderne PV-Strukturen Patienten schützen und Unternehmen stärken.
Pharmakovigilanz erscheint vielen Unternehmen zunächst wie ein loses Geflecht aus einzelnen Aufgaben und Zuständigkeiten, die nebeneinander verlaufen, ohne sichtbare Verbindung und Mehrwert. Start-ups meiden das Thema oft aufgrund seiner Komplexität und Bürokratie, während in großen Unternehmen starre Strukturen die Agilität und Reaktionsfähigkeit auf neue Signale oder regulatorische Vorgaben beeinträchtigen. Damit bleibt wertvolles Potenzial ungenutzt, sowohl in der Effizienz als auch in der Weiterentwicklung von Pharmakovigilanz als strategischem Erfolgsfaktor. Doch es geht auch anders. Mit einer modernen PV-Struktur lässt sich Pharmakovigilanz neu denken: smart, transparent und individuell.
Klinische Sicherheit & Pharmakovigilanz über den gesamten Produktlebenszyklus: Vom Labor bis zur Vermarktung
Arzneimittelsicherheit begleitet ein Produkt von der ersten Idee bis weit über die Markteinführung hinaus (siehe Abbildung 1). Bereits in der Forschungs- und Entwicklungsphase (R&D) steht das klinische Sicherheitsmanagement im Mittelpunkt: Potenzielle Risiken werden bewertet, Studien engmaschig überwacht und unerwünschte Arzneimittelwirkungen sorgfältig dokumentiert. In der Zulassungsphase nimmt das Nutzen-Risiko-Profil Gestalt an. Klinische Daten werden gebündelt, medizinisch bewertet und in regulatorische Dokumente integriert. Nach der Markteinführung beginnt die Pharmakovigilanz im eigentlichen Sinne. Sie sorgt für die Einhaltung der Good Pharmacovigilance Practices (GVP) und für eine kontinuierliche Optimierung des Nutzen-Risiko-Profils. Meldungen aus dem Markt, klinische Daten, wissenschaftliche Literatur sowie Erkenntnisse aus Real-World-Evidence und Registerstudien fließen in die kontinuierliche Nutzen-Risiko-Bewertung ein. Sie bilden die Grundlage für eine optimal und verantwortungsvolle Arzneimittelanwendung.

Die vier Kernbereiche moderner Pharmakovigilanz
Um das optimale Nutzen-Risiko-Profil in jeder Entwicklungsphase eines Arzneimittels verlässlich zu gewährleisten, braucht es klare Verantwortlichkeiten und ineinandergreifende Strukturen. Pharmakovigilanz darf kein loses Geflecht einzelner Aktivitäten sein, sondern muss als koordiniertes Zusammenspiel verschiedener Fachbereiche verstanden und gelebt werden.
Deshalb sollte jede Phase des Produktlebenszyklus auf vier zentralen Bereichen basieren, die eng zusammenarbeiten (siehe Abbildung 2). Jeder Bereich erfüllt spezifische, unverzichtbare Aufgaben, doch erst durch ihr Zusammenwirken entsteht ein ganzheitliches, agiles und medizinisch fundiertes Pharmakovigilanzsystem.
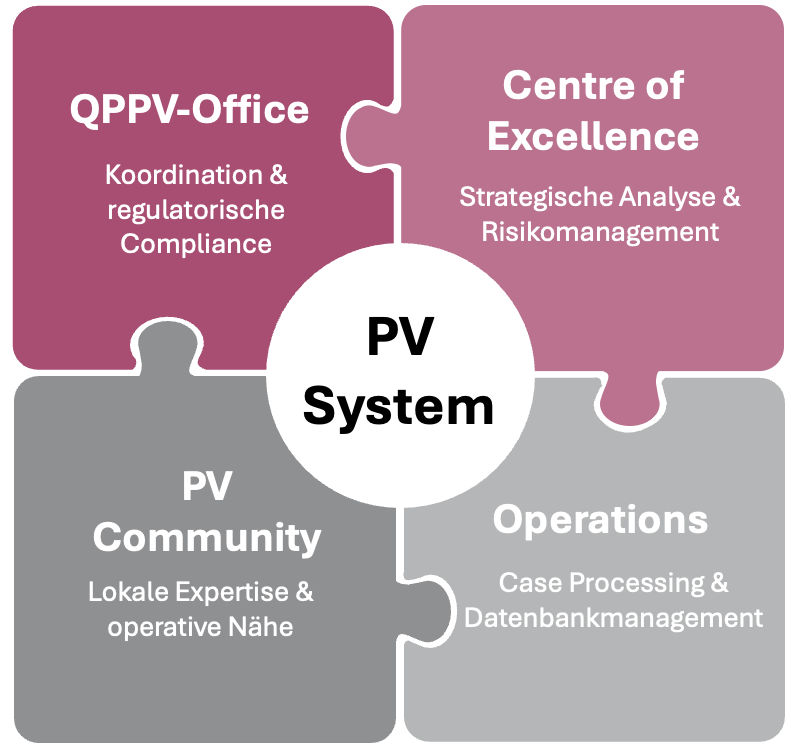
QPPV-Office– Koordination & regulatorische Compliance
Das QPPV-Office bildet den organisatorischen und regulatorischen Dreh- und Angelpunkt innerhalb einer Organisation. Es ist verantwortlich für die globale Steuerung und Koordination, für hohe Qualitätsstandards in allen Prozessen sowie für die Einhaltung regulatorischer Vorgaben im Unternehmen.
Im Mittelpunkt steht die Qualified Person Responsible for Pharmacovigilance (QPPV), die nach Art. 23 der Verordnung (EG) No 726/2004 die fachlich verantwortliche Person für die Überwachung und Aufrechterhaltung eines effektiven Pharmakovigilanz-Systems ist. Die Kernverantwortlichkeiten der EU QPPV umfassen die Überwachung und Aufrechterhaltung eines effektiven Pharmakovigilanz-Systems, die Bewertung und Meldung von unerwünschten Arzneimittelwirkungen, die Gewährleistung der Einhaltung gesetzlicher Vorschriften, die Entwicklung von Risikomanagementplänen, die Erstellung Sicherheitsberichten (z. B. PSURs) und die Schulung von Mitarbeitern. Die QPPV ist der direkte Ansprechpartner für alle Behörden und stellt sicher, dass das Nutzen-Risiko-Verhältnis der Arzneimittel jederzeit optimal für den Patienten bleibt.
Das Team ist verantwortlich für die Pharmakovigilanz-Stammdokumentation (Pharmacovigilance System Master File (PSMF)), welches von zentraler Bedeutung für das Unternehmen ist. Denn hier wird das gesamte Pharmakovigilanz-System im Überblick beschrieben, gleichzeitig spiegeln das Dokument und die damit einhergehenden Anhänge die weltweit verfügbaren Sicherheitsinformationen für alle zugelassenen Arzneimittel wider.
Im Rahmen der Regulatory Intelligence beobachtet das Team kontinuierlich globale sowie lokale Richtlinien, um frühzeitig und effizient auf Änderungen zu reagieren. Inspection Readiness ist unerlässlich, um jederzeit die Einhaltung von Vorschriften nachweisen zu können. Mit kontinuierlichen Audits, Schulungen und Prozessoptimierungen werden durch das QPPV-Office Risiken minimiert und die Effizienz gesteigert. Grundlage dafür ist die Erstellung und Pflege eines benutzerfreundlichen und prozessorientierten PV-SOP-Systems in enger Zusammenarbeit mit QA. PV-Verträge/Safety Data Exchange Agreements (SDEA) gehören ebenso in den Verantwortungsbereich des QPPV-Offices. Sie verantworten eine rechtssichere und praxisgerechte Gestaltung, um die Qualität der Arzneimittelsicherheit zu gewährleisten.
Centre of Excellence – Strategische Analyse & Risikomanagement
Das Centre of Excellence bildet das intellektuelle Zentrum der Pharmakovigilanz. Es bündelt wissenschaftliche Analyse, medizinische Bewertung und strategisches Risikomanagement in enger Abstimmung mit der QPPV.
Eine wesentliche Aufgabe des Centre of Excellences ist die Erstellung wichtiger regulatorischer Dokumente, um die Einhaltung globaler Arzneimittelsicherheitsvorschriften zu gewährleisten. Zu diesen Dokumenten gehören regelmäßige Sicherheitsberichte/Berichte zur regelmäßigen Nutzen-Risiko-Bewertung (PSURs/PBRERs), Risikomanagementpläne (RMPs), Entwicklungsberichte zur Sicherheitsaktualisierung (DSURs) und zusätzliche Überwachungsverpflichtungen (ACOs). Die effektive Erstellung dieser Dokumente erleichtert die kontinuierliche Überwachung, Bewertung des Sicherheitsprofils von Arzneimitteln.
Das Herzstück des Centre of Excellences liegt im Signal- und Risikomanagement zwei miteinander verbundene Prozesse zur Sicherstellung der Arzneimittelsicherheit: Signalmanagement identifiziert, bewertet und validiert neue potenzielle Risiken (Signale), während das Risikomanagement die daraus abgeleiteten Risiken bewertet, minimiert und präventive Maßnahmen zur Förderung einer sicheren Anwendung implementiert. Das Ziel ist es, sicherzustellen, dass der Nutzen die potenziellen Risiken überwiegt.
Ein weiterer elementarer Bestandteil ist die Steuerung der Safety Committees. In den interdisziplinären Beratungsgremien werden sicherheitsrelevante Daten und Signale diskutiert und in den Kontext des gesamten Produktlebenszyklus gesetzt, um medizinische und strategische Entscheidungen für die zukünftige Ausrichtung des Produkts abzuleiten. Die QPPV holt dabei die fachliche Einschätzung der unterschiedlichen Fachabteilungen ein, trifft jedoch die finale Entscheidung und trägt die regulatorische Gesamtverantwortung.
Gemeinsam mit dem QPPV-Office treibt das Centre of Excellence die strategische Weiterentwicklung der Pharmakovigilanz als Partner für alle Unternehmensbereiche voran. Es gestaltet Prozesse effizienter und entwickelt langfristige PV-Strategien. So entsteht ein Kompetenzzentrum, das nicht nur die Compliance gewährleistet, sondern auch Innovation, Exzellenz und medizinische Weitsicht fördert.
Operations– Case Processing & Datenbankmanagement
Der Bereich Operations bildet das Rückgrat der Pharmakovigilanz. Hier werden sicherheitsrelevante Informationen zu Arzneimitteln gesammelt, aufbereitet und für die weitere Bewertung bereitgestellt.
Im Mittelpunkt steht das Case Processing, sowohl im Pre- als auch im Postmarketing-Bereich. Fälle werden aufgenommen, codiert (nach MedDRA, Medical Dictionary for Regulatory Activities), und in Kooperation mit dem Centre of Excellence medizinisch bewertet, um ein kompaktes und aktuelles Sicherheitsprofil zu erstellen. Das Team stellt dann sicher, dass Fallinformationen fristgerecht an alle relevanten Behörden im aktuellen elektronischen Format übermittelt werden. Darüber hinaus verantwortet der Bereich Operations das Datenmanagement und die Pflege der PV-Datenbanken.
PV Community– Lokale Expertise & operative Nähe
Die PV Community verbindet zentrale Steuerung mit lokaler Umsetzung. Sie bringt Fachwissen aus allen Regionen zusammen und sorgt dafür, dass die Nähe zu regionalen Behörden und lokalen Anforderungen stets gewahrt bleibt.
Eine Schlüsselrolle übernehmen dabei die Local Contact Points, die jeweils für ein bestimmtes Land verantwortlich sind, wie in Deutschland der Stufenplanbeauftragte (SPB). Sie sind die ersten Ansprechpartner in ihren Regionen und arbeiten eng mit dem QPPV-Office zusammen, dem sie regelmäßig berichten. Gemeinsam stellen sie sicher, dass alle regulatorischen Anforderungen erfüllt und Pharmakovigilanzprozesse reibungslos umgesetzt werden.
Speziell in Deutschland trägt der SPB gemäß § 63a AMG die Verantwortung für ein funktionierendes PV-System, die Einhaltung aller Melde- und Berichtspflichten, einschließlich der Übersicht über eingereichte PBRER und RMP, sowie die Kommunikation mit den lokalen Behörden. In der täglichen Zusammenarbeit steht er in engem Austausch mit Operations, das u. a. eingehenden Meldungen sammelt, und dem Centre of Excellence, das diese bewertet und die PBRERs sowie RMPs erstellt.
Wenn Pflicht zur Chance wird
Für viele Unternehmen ist Pharmakovigilanz zunächst ein Pflichtprogramm, ein notwendiges, oft sperriges System, das Ressourcen bindet und scheinbar wenig zurückgibt. Gerade kleine Firmen können sich von der Komplexität erschlagen fühlen, während große Organisationen an ihrer eigenen Bürokratie zu scheitern drohen.
Doch Pharmakovigilanz ist weit mehr als ein regulatorisches Muss. Moderne Pharmakovigilanz zeigt, dass es auch anders geht: Wenn zentrale Einheiten wie das QPPV-Office, die PV Community, Operations und das Centre of Excellence ineinandergreifen, entsteht ein vernetztes System, das Transparenz schafft, individuelle Lösungen ermöglicht und durch effiziente Prozesse überzeugt.
Was anfangs wie ein loses Geflecht aus einzelnen Fäden wirkt, entfaltet durch Zusammenarbeit und klare Ausrichtung die Struktur eines Netzes, das trägt, schützt und verbindet. Wer Pharmakovigilanz von Beginn an als Chance versteht, schafft nachhaltige Sicherheit, für Patienten, für das Unternehmen und für die Zukunft.