Wir sind am 01.04. umgezogen! Unsere neue Adresse ist: Reimerstwiete 11, 20457 Hamburg
Eine Analyse der EMA-Zulassungsdaten aus zentralen Verfahren zu antineoplastischen Arzneimitteln.
Die Arzneimittelforschung befindet sich in einem stetigen Wandel, geprägt von neuen wissenschaftlichen Erkenntnissen und regulatorischen Anforderungen. Nach dem Überblick über zentrale Zulassungsverfahren aus dem vergangenen Jahr zeigt dieser Artikel aktuelle Trends und strategische Entwicklungen in diesem dynamischen Bereich.
Die Analyse über die zentral eingereichten Zulassungsanträge zeigte eine stabile Entwicklung mit durchschnittlich etwas mehr als 80 Neuzulassungen pro Jahr im Betrachtungszeitraum 2013 bis 2023. Auch im vergangenen Jahr bestätigte sich die konstant hohe Rate an Neuzulassungen mit 114 positiven Opinions und 80 Marktzulassungen [1]. Eine besonders dynamische Entwicklung zeigt sich dabei in der Onkologie: Bei Betrachtung des Zeitraumes von 2018 bis 2024 war etwa jede fünfte zentrale Zulassung auf ein onkologisches Arzneimittel zurückzuführen. Die medizinische Relevanz ist unumstritten, Krebs bleibt weltweit eine der häufigsten Todesursachen. Die steigende Inzidenz onkologischer Erkrankungen wird den Bedarf an innovativen Behandlungen sowie lösungsorientierten regulatorischen Strategien erhöhen. Schätzungen zufolge wird die Zahl der Neuerkrankungen von circa 20 Millionen jährlich bis 2050 auf bis zu 32 Millionen ansteigen [2].
Ein Blick auf die Verteilung der Krebserkrankungen zeigt, dass knapp die Hälfte aller Neuerkrankung auf Mammakarzinome sowie Krebserkrankungen des Kolons, der Lunge und der Prostata zurückzuführen sind (Abbildung 1). Während die 5-Jahres-Überlebensraten bei Mamma- und Prostatakarzinomen mit über 80 % hoch sind, liegen sie bei Bronchialkarzinomen lediglich bei 22 %. Der daraus berechnete Koeffizient zum medical need dieser Erkrankung erreicht im Vergleich den höchsten Wert. Er ergibt sich aus der Multiplikation der relativen 5-Jahres-Überlebensrate mit dem Anteil an Krebsneuerkrankungen. Hinsichtlich der Überlebensrate bei Bronchialkarzinomen in den 2000er Jahren lässt sich mit einem relativen Anstieg von 48% bereits eine positive Entwicklung feststellen [4]. Dies ist nicht zuletzt auf den Anteil antineoplastischer Forschung zurückzuführen, der auch in IQVIA Auswertungen deutlich wird. Im vergangenen Jahr waren 25 % der klinischen Studien der Entwicklung neuer onkologischer Wirkstoffe gewidmet [2].

Während die Therapieoptionen sich jahrzehntelang in Operation(en), Chemotherapie oder Bestrahlung(en) erschöpften, konzentriert sich die Wirkstoffentwicklung heute zunehmend auf zielgerichtete Therapieansätze. Im Rahmen dieser target therapies werden tumorspezifische Stoffwechselwege adressiert, darunter spezifische Enzym-Inhibitoren oder Antikörperderivate. Auch immunmodulatorische Wirkstoffe werden eingesetzt, um Wachstumsvorgänge zu modulieren oder apoptotische Vorgänge in Krebszellen zu induzieren. Diese gezielte Spezifität auf Tumorgewebe trägt zur Reduktion von Nebenwirkungen bei und steigert die Therapieeffektivität. Nicht überraschend ist daher der in den letzten zehn Jahren deutlich zunehmende Anteil an Antikörperderivaten und Proteinkinase-Inhibitoren, während die Zulassungen von Antimetaboliten und alkylierenden Wirkstoffen zurückgegangen sind (Abbildung 2). Zudem gewinnen Kombinationstherapien und Ansätze zur Wirkverstärkung zunehmend an Bedeutung. Die bereits erwähnten niedrigen Überlebensraten des aggressiven Bronchialkarzinoms lassen sich vornehmlich durch die Entwicklung von Resistenzen nach der Erstbehandlung erklären. Entscheidend für den Behandlungserfolg sind daher unter anderem Strategien, die eine mögliche Resistenzentwicklung minimieren. Vorläufige Ergebnisse einer offenenPhase-I-Studie deuten bereits darauf hin, dass die Wirksamkeit eines PD-1-Checkpoint-Inhibitors durch die Kombination mit speziellen Bakterien, die sich als „Live Biotherapeutic Products“ (LBP) im Darm ansiedeln, bei Bronchialkarzinomen gesteigert werden kann. Auch Tumorimpfungen, zuletzt insbesondere inKombination mit Checkpoint-Inhibitoren, sind Gegenstand aktueller Forschung.

Ein weiterer Trend in der onkologischen Arzneimittelentwicklung sind die Indikationserweiterungen. Im Verhältnis zu 32 beantragten Indikationserweiterungen im Jahr 2014 haben sich diese in den letzten zehn Jahren mehr als verdoppelt. Während 2014 die Zahl der Neuzulassungen und Indikationserweiterungen noch identisch war, wurden 2024 bereits 80 % mehr Indikationserweiterungen im Vergleich zu den antineoplastischen Neuzulassungen dieses Jahres beantragt (Abbildung 4).
Die strategische Erweiterung des therapeutischen Nutzens ist dabei ein vielfach genutzter adaptiver Ansatz, um Therapielücken schließen zu können. Sie ermöglicht das Potenzial eines bereits zugelassenen Wirkstoffs gezielt auszubauen, sodass der Zugang zu neuen Patientengruppen ausgebaut und die Marktposition gestärkt werden kann. Neben Daten aus kontrollierten klinischen Studien rücken dabei zunehmend Real World Data (RWD) in den Fokus. Diese können nicht nur zur Identifikation geeigneter Subgruppen beitragen, sondern auch als unterstützende bevölkerungsrepräsentative Real World Evidence (RWE) in Zulassungsverfahren herangezogen werden, wodurch nicht zuletzt finanzielle Ressourcen eingespart werden können. Bei 111 Neuzulassungen durch die EMA in den Jahren 2018 und 2019 enthielten alle Daten aus RWE [7]. Während die Verwendung im Rahmen der Post Market Surveillance bereits etabliert ist, finden diese nun auch zunehmend im Bereich der Arzneimittelentwicklung Anwendung. In diesem Zeitraum untersuchte antineoplastische Arzneimittel stützten sich bei der klinischen Entwicklung in 50% der Fälle auf RWE [7]. Der im vergangenen Jahr veröffentlichte Scientific Explorer der EMA als KI-unterstützendes Instrument für europäische Zulassungsbehörden und der im selben Jahr veröffentlichte Leitfaden zur Nutzung von RWE bestätigen das Potential. Der zunehmende Einsatz von RWD/RWE, vor allem vor dem Hintergrund der Implementierung künstlicher Intelligenz, erfordert eine sorgfältig abgestimmte Strategie, die medizinische Evidenz mit regulatorischen und wirtschaftlichen Rahmenbedingungen für eine erfolgreiche Zulassung verknüpft.
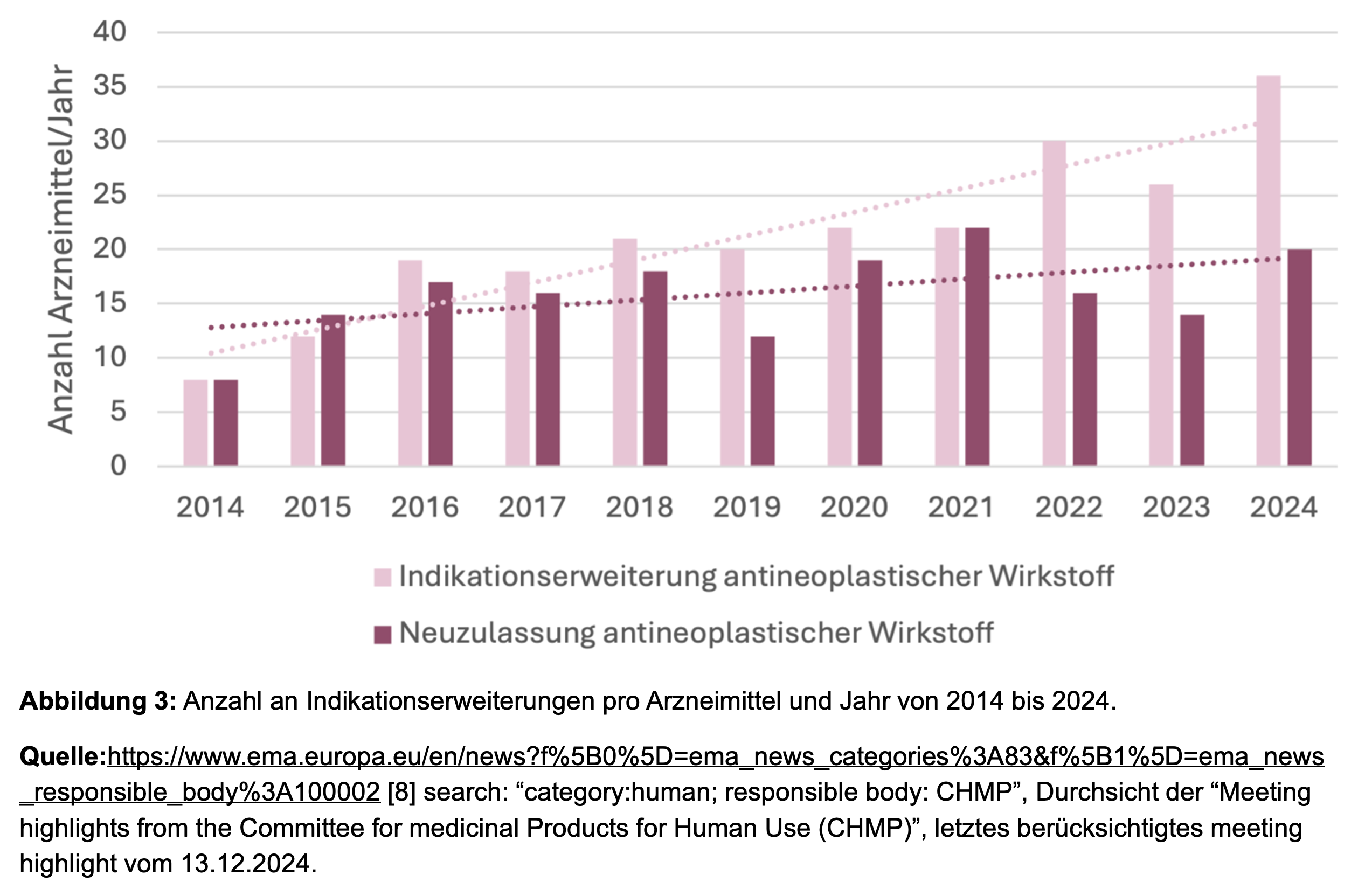
Der bereits erwähnte Einsatz von Real World Data kann das komplexe Zusammenspiel zentraler Faktoren in der Wirkstoffentwicklung, wie dem Vorhandensein adressierbarer Targets, dem Marktpotential sowie dem medizinischen Bedarf (Vergleich Abbildung 1), zielgerichtet ergänzen und zur erfolgreichen Entwicklung neuer Therapieansätze beitragen. So kam es in den vergangenen zwei Jahren zu Neuzulassungen in zwei Erkrankungen mit hohem medical need, bei denen sich seit über 20 Jahren keine signifikanten Veränderungen in den Sterberaten zeigten [4]. Im Bereich der Ösophagus-Karzinome sowie Gliome wurde in den letzten beiden Jahren jeweils ein neuer Wirkstoff zugelassen (Abbildung 4), unterstützt unter anderem durch Erkenntnisse aus Real World Data zur Identifizierung von Subgruppen und adressierbaren Zielstrukturen.
.png)
Der weiterhin hohe Therapiebedarf in der Onkologie und die schnelle Entwicklung neuer Wirkstoffe lassen erwarten, dass dieser Bereich auch künftig im Fokus der Forschung stehen wird. Die Vielfalt an Behandlungsmöglichkeiten wird perspektivisch eine noch präzisere und individuellere Therapie der Patienten ermöglichen, um den Herausforderungen dieser vielseitigen Krankheit zu begegnen.
Referenzen
Hinweise zu Limitationen: