Wir sind am 01.04. umgezogen! Unsere neue Adresse ist: Reimerstwiete 11, 20457 Hamburg
Was GDP-Non-Compliance-Reports über strukturelle Schwächen verraten.
Aktuell sind in der EudraGMDP-Datenbank 50 öffentlich zugängliche GDP-Non-Compliance-Reports gelistet: Ein klarer Hinweis darauf, dass Verstöße gegen die Anforderungen der Guten Vertriebspraxis (GDP) keine Einzelfälle sind. Sie offenbaren oft grundlegende strukturelle Schwächen in Organisation, Verantwortung und Umsetzung innerhalb pharmazeutischer Großhandelsunternehmen.
Deshalb lohnt sich ein genauer Blick. Welche wiederkehrenden Muster lassen sich erkennen? Welche Rückschlüsse lassen sich für die eigene Vorbereitung auf zukünftige Inspektionen ziehen?
Wir haben die aktuellen Non-Compliance-Reports analysiert und die wichtigsten Erkenntnisse zusammengefasst.
Was ist die EudraGMDP?
Die EudraGMDP-Datenbank stellt seit ihrer Einführung im April 2007 das zentrale europäische Verzeichnis für GMP- und GDP-Zertifikate sowie für Meldungen zur Non-Compliance dar. Sie wird von der Europäischen Arzneimittelagentur (EMA) betrieben und dient den zuständigen Behörden der EU-Mitgliedstaaten als wesentliches Instrument der Arzneimittelüberwachung. Ursprünglich ausschließlich für GMP-Daten konzipiert, wurde die Datenbank im Zuge der Umsetzung der Fälschungsschutzrichtlinie 2011/62/EU im Jahr 2014 um GDP-relevante Inhalte erweitert. Darunter sind auch sogenannte GDP-Non-Compliance-Reports zu finden, also öffentliche Meldungen über schwerwiegende Verstöße gegen die gute Vertriebspraxis.
Trotz des gemeinsamen europäischen Rahmens verlief die technische Anbindung der nationalen Inspektions- und Zulassungssysteme an EudraGMDP keineswegs einheitlich. Viele Länder, darunter Spanien mit seinem System Labofar, arbeiteten mit eigenständigen nationalen Plattformen. Diese mussten zunächst aufwändig an die EMA-Infrastruktur angebunden werden, was den Datenfluss in der Anfangsphase erschwerte oder verzögerte. In Deutschland etwa übernimmt PharmNet.Bund die Schnittstelle. Hier erfolgt eine werktägliche Übermittlung geprüfter GDP- und GMP-Dokumente durch das BfArM an die EMA [1].
Frankreich hingegen zählt zu den Ländern, die vergleichsweise spät in den digitalen Datenfluss einstiegen. Noch neun Jahre nach dem Start der Datenbank wurden dort GMP-Zertifikate ausschließlich in Papierform ausgestellt. Erst am 15. April 2016 begann die französische Arzneimittelbehörde ANSM, GMP-Zertifikate in EudraGMDP zu veröffentlichen [2]. Diese verspätete Integration markierte jedoch den Beginn eines stärkeren Engagements Frankreichs für digitale Transparenz im regulatorischen Umfeld.
Ein Meilenstein in der technischen Weiterentwicklung der Datenbank war die Einführung des SPOR-Frameworks (Substance, Product,Organisation and Referential master data). Insbesondere die Integration des Organisation Management Service (OMS) im Januar 2022 brachte eine tiefgreifende Änderung mit sich: Seitdem ist es den nationalen Behörden nur noch möglich, Zertifikate oder Non-Compliance-Meldungen zu erstellen, wenn das betroffene Unternehmen mit korrekten Stammdaten im OMS registriert ist. Diese Maßnahme fördert die Standardisierung und Interoperabilität innerhalb des EU-Zulassungssystems und stellt sicher, dass sämtliche Daten konsistent und eindeutig referenziert werden können.
Was muss gemeldet werden?
Die Meldepflichten in EudraGMDP sind durch mehrere EU-Rechtsakte festgelegt, namentlich durch die Richtlinie 2001/83/EG für Humanarzneimittel, die Richtlinie 2001/82/EG für Tierarzneimittel sowie die Fälschungsrichtlinie 2011/62/EU. Sie verpflichten nationale Behörden, alle relevanten Informationen über:
· Herstellungs- und Großhandelserlaubnisse,
· GMP- und GDP-Zertifikate,
· Registrierungen von Wirkstoffherstellern,
· sowie Bestätigungen der GMP- oder GDP-Nichtkonformität
in die zentrale EU-Datenbank zu melden.
Besonders deutlich wird dies in Artikel 111 Absatz 7 derRichtlinie 2001/83/EG, der besagt:
„[wenn] die inspizierte Stelle die gesetzlichen Vorschriften und/oder die Grundsätze und Leitlinien des Unionsrechts zur Guten Herstellungspraxis oder zur Guten Vertriebspraxis nicht einhält, so wird diese Information in der Datenbank der Union registriert.“
Bei Betrachtung der Länderverteilung der eingesehenen Meldungen wird deutlich, dass trotz dieser Verpflichtung aktuell kein GDP-Non-Compliance Report aus Frankreich einsehbar ist (siehe Abbildung 1). Unter den meldenden Ländern repräsentieren Deutschland (24 %), Tschechien (22 %) und Rumänien (16%) aller Reports.
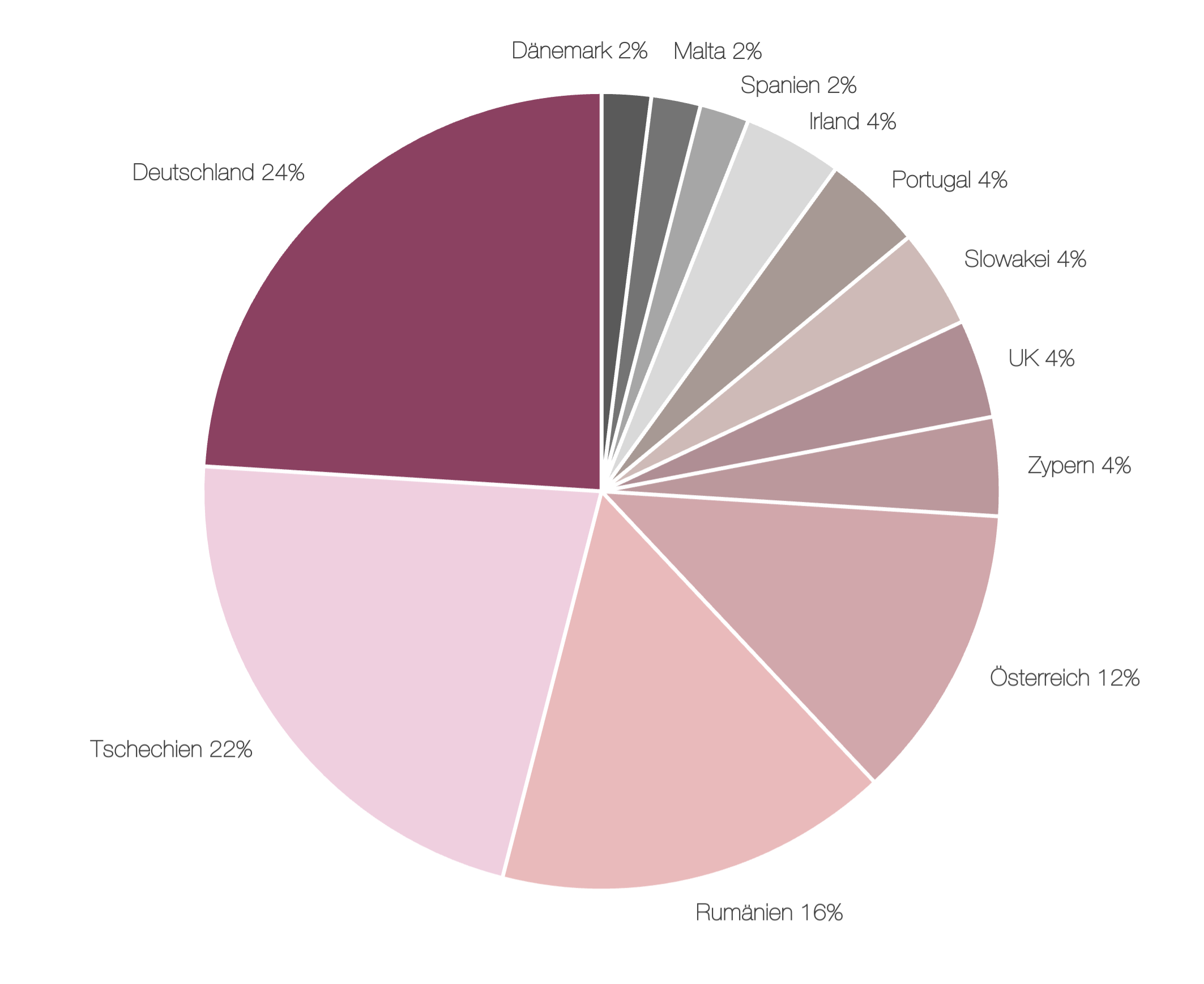
Wie lässt sich diese Diskrepanz begründen? Da die zuständigen nationalen Behörden der Übermittlung dieser Meldungen teilweise nicht nachkommen, sind darüber lediglich Spekulationen möglich. Die Liste der zuständigen nationalen Behörden im europäischen Wirtschaftsraum zeigt, dass in Deutschland mit insgesamt 47 zuständigen Überwachungsbehörden ein besonders dichtes Netz und damit die Basis für eine gut etablierte und regelmäßige Inspektionspraxis bereitsteht [4]. Die hohe Anzahl an meldenden Behörden könnte demnach zu einer vergleichsweise hohen Anzahl an veröffentlichten Non-Compliance-Reports in Deutschland geführt haben. Allerdings sind diese Überlegung nicht auf andere Mitgliedsstaaten übertragbar, welche in der Regel nur eine bis drei zuständige Stellen vorweisen [4]. Dennoch lohnt sich ein genauerer Blick auf die beobachteten Mängel.
Was lässt sich aus diesen Reports lernen?
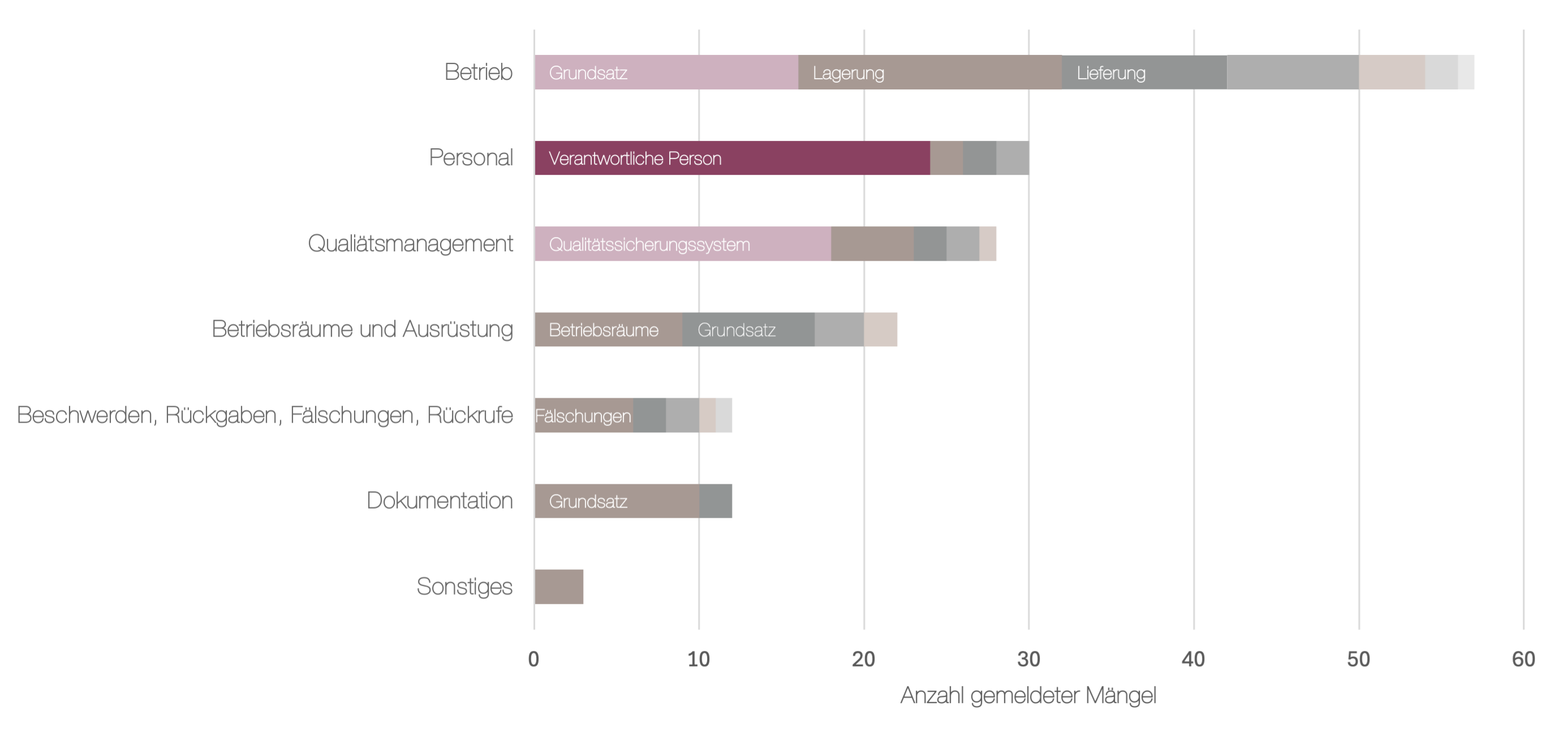
Unsere Analyse zeigt: Es sind nicht Einzelfehler, sondern strukturelle Schwächen, die immer wieder auffallen. Hierfür haben wir alle verfügbaren Reports hinsichtlich ihrer gelisteten Mängel ausgewertet und den entsprechenden Kapiteln der GDP-Leitlinie zugeordnet, wobei einem Report meist mehrere Mängel zuzuordnen waren. So konnten wir Mängel aggregieren und thematisch clustern.
Die nachfolgende Grafik zeigt die Verteilung der gemeldeten Mängel auf die Kapitel der GDP-Guideline. Der Bereich Betrieb ist mit Abstand am stärksten betroffen, gefolgt von Personal und Qualitätsmanagement. Besonders auffällig ist dabei, dass innerhalb des Kapitels Personal die meisten Beanstandungen direkt mit einer zentralen Schlüsselrolle verbunden sind, der Verantwortlichen Person.
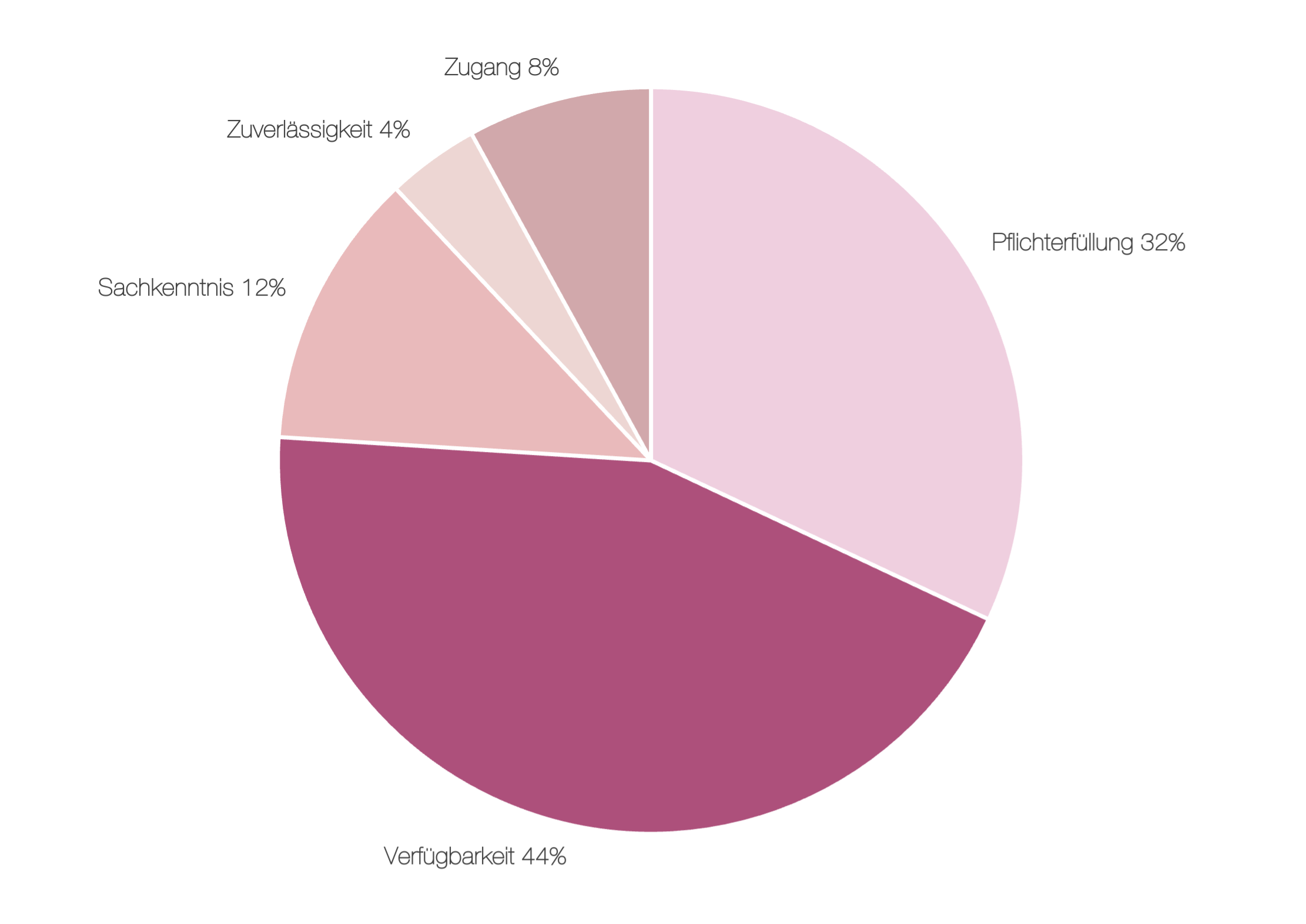
Ein genauerer Blick zeigt, dass in mehr als drei Viertel der beanstandeten Fälle zur Verantwortlichen Person diese entweder nicht verfügbar, nicht dauerhaft benannt oder ihrer Rolle im Sinne der gesetzlichen Vorgaben nicht gerecht geworden war (Abbildung 3). Dabei ist diese Funktion für jeden Arzneimittelgroßhändler verpflichtend vorgesehen, welches in Deutschland durch §52a AMG geregelt wird.
Viele dieser Beanstandungen ließen sich durch klare Zuständigkeiten, gelebte Einbindung in das Qualitätssystem und eine angemessene Qualifikation der eingesetzten Personen vermeiden. Ein regelmäßiger Abgleich der bestehenden Strukturen mit den regulatorischen Anforderungen ist daher nicht nur rechtlich geboten, sondern entscheidend für einen erfolgreichen pharmazeutischen Großhandel.
Ein erster Blick – mit Potential für mehr
Mit unserer Auswertung konnten wir einen ersten Einblick davon gewinnen, welche GDP-Kapitel in der Praxis besonders anfällig für behördliche Beanstandungen sind. Die Datenbank bietet damit nicht nur Transparenz, sondern auch die Chance aus den Fehlern anderer zu lernen. Wir werden die Entwicklungen aufmerksam weiterverfolgen und damit eine Brücke zwischen regulatorischer Theorie und operativer Realität schlagen.
So können wir gemeinsam aus konkreten Fällen lernen und GDP-Compliance nicht nur verwalten, sondern aktiv gestalten.
In den vergangenen Jahren haben wir zahlreiche Unternehmen bei genau diesen Herausforderungen erfolgreich begleitet: sei es bei der Stellung einer Verantwortlichen Person, dem Aufbau und der Weiterentwicklung von Qualitätssystemen, der Vorbereitung auf Inspektionen oder bei der praxisnahen Schulung von Personal.
Stehen auch Sie vor dieser Herausforderung? Dann melden Sie sich gerne bei uns!
Referenzen